국내 연구진이 기억에 중요한 역할을 담당하는 해마 신경세포를 보호할 수 있는 유전자 구조체(벡터)를 제작하고, 그 보호과정을 규명하였다.
경북대 김상룡 교수와 경희대 진병관 교수 연구팀은 노인성 뇌질환인 치매에 대한 유전자 치료제로서 그 가능성을 타진하기 위해 해마 부위에서 신경독성 물질로 작동될 수 있는 트롬빈(Thrombin)에 대한 AAV-Rheb(S16H)의 신경세포 보호 및 그 기전 연구를 진행하였다.
먼저 정상 쥐의 해마신경세포에 AAV-Rheb(S16H)를 도입하여 신경세포에 대한 영양인자 유도현상(신경세포 크기 증가 및 신경영양인자 발현 증가)을 관찰할 수 있었다. 특히, 해마신경세포의 성장 및 생존에 필수적인 영양인자인 Brain-derivecd neurotrophic factor(BDNF)의 증가가 실제 신경세포 내에서 유도될 수 있음을 확인하였다. 연구팀은 또 기억과 관련된 중요 신경전달 물질인 아세틸콜린(Acetylcholine) 양이 크게 증가된다는 것을 확인하였다.
고령화에 따라 알츠하이머병과 같은 치매와 파킨슨병 환자가 급속히 증가함에도, 신경세포가 점차 손상되는 신경퇴화라는 노인성 뇌질환의 공통적인 병리현상의 원인은 명확히 규명되지 않았다. 현재 신경퇴화를 저지하거나 퇴화로 소실된 뇌기능 회복이 어렵고, 다만 증상완화를 위한 치료에 그치고 있다.
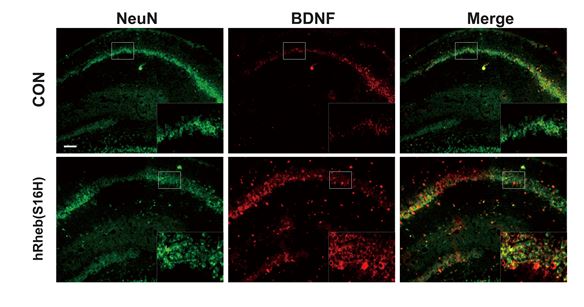
연구팀이 개발한 신경 독성물질로부터 해마 신경세포를 보호할 수 있는 유전자 구조체는 노인성 뇌질환 관련 신경퇴화 저지를 위한 실마리가 될 것으로 기대된다. 구조체에는 신경세포의 생존과 성장에 중요한 단백질(mTORC1)의 활성을 유도하는 단백질(Rheb(S16H))에 관한 정보가 들어있어 신경세포 보호효과를 갖기 때문이다. 실제 신경독성 물질에 노출된 쥐에 유전자 구조체를 주입한 결과, 해마신경세포의 사멸이 현저히 감소하는 것으로 나타났다.
이는 치매 관련 유전자 치료제 개발의 단서가 될 수 있어 후속연구로 이어질 수 있을 것으로 예상된다. 향후 노인성 치매 관련 유전자 치료제로서 그 가능성을 확고히 하기 위해 손상된 해마조직에서의 Rheb(S16H) 발현 유도가 어떤 역할을 할 수 있는지 규명하는 후속연구가 필요하고 이러한 연구결과는 증상완화 수준에 머무르고 있는 노인성 뇌질환 치료제 개발에 도움을 줄 수 있을 것으로 보인다.
김상룡 교수는 “이번 연구결과는 노인성 뇌질환과 연관될 수 있는 성체신경세포의 활성과 보호를 위해 어떤 타깃을 고려해야 될 지 중요한 단서를 제공하는 것”이라고 연구의의를 밝혔다.
경북대 김상룡 교수와 경희대 진병관 교수 연구팀이 주도한 이번 연구는 미래창조과학부가 추진하는 신진연구자 지원사업과 선도연구센터 지원사업의 지원으로 수행되었고, 연구결과는 생명공학 및 응용미생물학 분야의 권위지이자 Nature의 자매지인 Molecular Therapy 온라인판(1월 13일자)에 게재되었다.
※(논문 제목) In vivo AAV1 transduction with hRheb(S16H) protects hippocampal neurons by BDNF production